LES PRÉLÈVEMENTS SANGUINS et URINAIRES (hors microbiologie)
1. LE MATÉRIEL UTILISE
- Aiguilles.
- Gants
- Tubes à prélèvements sous vide.
- Garrot.
- Coton.
- Alcool à 70°.
- Pansements.
- Gel pour la désinfection des mains.
- Boîte récupératrice d’aiguilles, poubelle pour déchets contaminés et poubelle pour déchets non contaminés.
2. LE PRÉLÈVEMENT SANGUIN SELON PROTOCOLE EN VIGUEUR DANS L’ÉTABLISSEMENT
- Réaliser un lavage des mains par friction avec la solution hydroalcoolique (SHA)
- Vérifier l’identité du patient (nom, prénom, nom de jeune fille, sexe, date de naissance)
- Vérifier la prescription
- Vérifier la date de péremption des tubes
- Vérifier l’intégrité des emballages
- Vérifier l’absence de lésion cutanée
- Poser le garrot
- Repérer la veine, desserrer le garrot en le laissant sur le bras
- Monter l’aiguille sur le corps de pompe
- Enfiler des gants non stériles à usage unique
- Réaliser l’antisepsie du site à ponctionner : « 3 bandes » en remontant ou « escargot », ne jamais repasser 2 fois au même endroit
- Serrer le garrot et faire serrer le point : saillie de la veine
- Réaliser le prélèvement
- Éliminer l’ensemble du matériel de prélèvement dans le collecteur adapté
- Ôter les gants et les jeter
- Homogénéiser les tubes par 6 à 8 retournements lents de l’échantillon
- Réaliser l’étiquetage des tubes au chevet du patient.
- L’étiquette doit au minimum mentionner le nom, le prénom, le nom de jeune fille et la date de naissance.
- Réaliser un lavage des mains à l’aide du SHA
- Coller les étiquettes sur le bon de laboratoire
- Mentionner l’identité du prescripteur sur le bon de laboratoire
- Mentionner l’identité du préleveur, la date et l’heure du prélèvement sur le bon de laboratoire.
3. LE SANG ARTÉRIEL
Le recueil de sang artériel pour les gaz du sang est généralement réalisé par ponction de l’artère radiale.
4. LE SANG CAPILLAIRE
Le recueil du sang capillaire se fait à l’aide d’une lancette pour analyse immédiate par bandelette (glycémie) ou chez les enfants difficiles à piquer.
5. LES PRÉLÈVEMENTS VEINEUX
Le sang veineux est obtenu par ponction d’une veine à l’aide de matériel approprié pour analyse ou hémoculture.
Ne jamais piquer un bras:
- Avec un dispositif de perfusion en cours
- Avec un dispositif de fistule rénale (hémodialyse)
- Du côté du sein opéré chez une femme mammectomisée
- Du côté paralysé chez un hémiplégique
- Si dermatose
Une vigilance particulière sera portée aux personnes sous traitement anticoagulant ou qui souffrent de troubles de la coagulation.
6. LE MATÉRIEL DE PONCTION
Choisir le matériel de ponction en fonction de la qualité de la veine et du type de prélèvement à effectuer.
| Le système vacutainer sous vide est un dispositif qui permet une bonne protection des soignants | ||
Corps de prélèvement |  | Couleur différente selon diamètre de l’aiguille Verte ou noire Vertes:diamètre supérieure aux Noires |
| Le système à hémoculture | ||
Corps de prélèvement |  | |
| Les aiguilles épicrâniennes avec adaptateur vacutainer® ou aiguilles de ponction, sont utilisées en pédiatrie et pour les personnes dont le capital veineux est pauvre | ||
Corps de prélèvement |  | Epicranienne |
| Les cathéters courts avec adaptateur Vacutainer™ pour perfusion intraveineuse permet également de prélever du sang veineux (protocole spécifique à respecter) | ||
Corps de prélèvement  |  |
7. LES TUBES : QUANTITÉ ET REMPLISSAGE
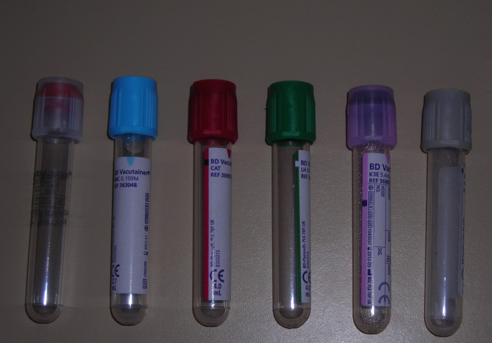
LES TUBES STANDARDS ET A VOLUME RÉDUIT

Le tube citraté bouchon bleu (volume 2.7 ml ou volume réduit) doit être impérativement bien rempli.


Les tubes héparinés et fluorés doivent contenir au minimum environ 2ml de sang total

Le tube EDTA doit contenir au minimum environ 1ml de sang total (2ml pour les groupes sanguin)

Le tube sec doit contenir au minimum environ 2ml de sang total

Le tube de purge doit être éliminé dans les DASRI (et non transmis au laboratoire)
Tubes standards
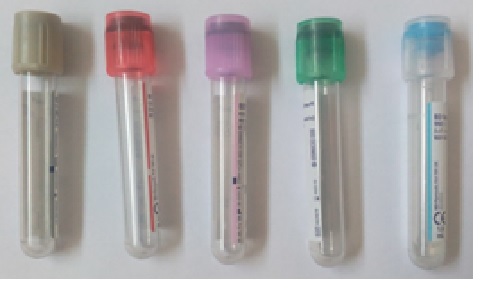
Tubes à volume réduits
Les micro tubes




Les micro-tubes héparinés, fluorés et secs doivent être remplis le plus possible.

Le micro-tube EDTA doit être rempli avec un minimum de 250µL (500µl pour les groupes sanguins)

Le micro-tube citraté doit être impérativement bien rempli
Les tubes à volume réduit sont réservés pour les patients difficiles à piquer et pour les enfants.
Les micro-tubes sont réservés pour les jeunes enfants ou les patients très difficiles à piquer (uniquement en Pédiatrie,Urgences,Obstétrique,Bloc Obstétrical).
NATURE ET QUANTITÉ DE TUBES A PRÉLEVER
Choisir les tubes de prélèvement en fonction de la prescription.
Afin de connaitre le nombre de tubes nécessaires ainsi que les associations d’examens possibles sur le même échantillon, consulter le bon de prescription
Les tubes peuvent être sans additif, ou avec un anticoagulant pour les analyses sur sang total ou plasma.
Le guide du prélèvement précise pour chaque examen le ou les matériel(s) adapté(s) à l’échantillon et à l’analyse souhaitée.
- Tous les tubes de type vacutainer™ sont sous vide, il ne faut en aucun cas les ouvrir. Le vide permet l’aspiration d’un volume de sang calculé pour respecter le ratio sang / anticoagulant.
- Chaque tube est identifiable par une couleur de bouchon et une étiquette spécifique.
- Comme pour tout matériel stérile, la date de péremption des tubes doit être vérifiée et les tubes périmés doivent être éliminés
CHOISIR LE SITE DE PONCTION ET POSER LE GARROT
Un prélèvement veineux peut se faire sur tout le réseau veineux superficiel du pli du coude, de l’avant bras et du dos de la main.
Le garrot doit être posé à 7,5/10 cm au dessus du point de ponction, le pouls doit demeurer perceptible et le temps de pose du garrot ne doit pas dépasser 1 minute.
- Au-delà d’une minute de pose, la stase veineuse provoque une hémoconcentration.
- Lors de la recherche du site de ponction, si le garrot est posé depuis plus d’1 minute, le desserrer pendant 2 à 3 minutes et le remettre en place.
- Avec les tubes sous vide, dès que le sang afflue dans le tube, le garrot doit être desserré.
- Éliminer le garrot s’il est contaminé lors du prélèvement.
EFFECTUER LA PONCTION – ORDRE DE PRÉLÈVEMENT DES TUBES
Mettre des gants non stériles.
- Désinfecter le site de la ponction et laisser sécher avant de réaliser le prélèvement.
- Ne jamais palper le site après désinfection.
- Lors du prélèvement positionner le tube, étiquette vers le bas pour pouvoir visualiser l’arrivée du sang dans le tube.
- Si le tube a été introduit dans le corps de prélèvement et percuté avec l’étiquette au-dessus, gênant
la visibilité du remplissage du tube, le retirer du corps, le tourner (étiquette en dessous) et le réintroduire. Cette manipulation n’entraîne pas de perte de vide.
- Ne jamais faire tourner le tube dans le corps de prélèvement lorsqu’il est déjà percuté.
Effectuer le prélèvement des tubes selon l’ordre recommandé dans le tableau qui suit et veiller au bon remplissage des tubes
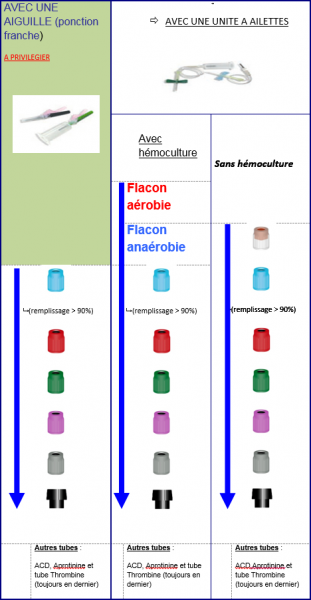
- Veiller au bon remplissage des tubes.
- Homogénéiser le tube, dès le retrait du corps de prélèvement, par plusieurs retournements lents.
- Identifier les tubes.
- Veiller à respecter les conditions recommandées de prélèvement et de transport.
8. LES TESTS DYNAMIQUES
Contacter le laboratoire de Biochimie ou un biologiste
9. LES CRYOGLOBULINES
Le Patient doit être au chaud et à jeun.
– Le matériel de prélèvement (2 tubes secs maintenus à 37°C dans un récipient thermo).
– Avant 16 H, du lundi au vendredi et en dehors des jours fériés.
– Le temps écoulé entre le départ de la boîte du laboratoire et son retour avec le prélèvement du service ne doit pas dépasser 30 minutes.
Toute demande de cryoglobuline ne respectant pas ces modalités sera refusée par le laboratoire, car toute baisse de température peut être responsable de la perte en proportion variable de la cryoglobuline pouvant même aboutir à un résultat faussement négatif.
10. RECUEIL DES URINES DE 24 HEURES pour Biochimie
RECUEIL D’URINES PAR LE PATIENT
- Le matin au lever, uriner aux toilettes (jeter les urines).
- Noter l’heure
- Jusqu’au lendemain matin, même heure, recueillir toutes les urines des 24 heures dans le flacon remis par le laboratoire

- Identifier le récipient à l’aide de l’étiquette fournie par l’hôpital
- Apporter le flacon au laboratoire le plus rapidement possible
RECUEIL D’URINES PAR LE PERSONNEL SOIGNANT
A PARTIR DU CONTAINER DE 24H
- Mesurer le volume total d’urines recueillies sur 24h (noter diurèse)

- Plonger la canule dans le flacon contenant les urines de 24h.
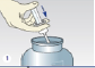
- Insérer le tube à urine sans additif (tube beige) et le percuter
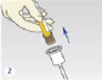
- Attendre le remplissage complet du tube et le retirer
- Transmettre le tube au laboratoire, à température ambiante, dans les meilleurs délais
11. RECUEIL DES URINES sur échantillon pour Biochimie
RECUEIL D’URINES PAR LE PATIENT
- Uriner le premier jet dans les toilettes (20ml)
- Recueillir le 2ème jet d’urine dans le pot à couvercle bleu, le refermer immédiatement (volume minimum 10 ml)

- Identifier le récipient à l’aide de l’étiquette fournie par l’hôpital
- Apporter le flacon au laboratoire le plus rapidement possible
RECUEIL D’URINES PAR LE PERSONNEL SOIGNANT
- Uriner le premier jet dans les toilettes (20ml).
- Recueillir le 2ème jet d’urine dans le pot à couvercle bleu, le refermer immédiatement (volume minimum 10 ml).

- Homogénéiser les urines
- Retirer l’étiquette de protection (ne pas la jeter).
- Insérer le tube sans additif beige dans l’orifice et le percuter


- Le maintenir en position jusqu’à ce que le remplissage s’arrête
- Homogénéiser par 8 à 10 retournements
- Identifier le récipient à l’aide de l’étiquette fournie par l’hôpital
- Apporter le tube beige au laboratoire le plus rapidement possible
12. EXAMEN PHYSIQUE ET CHIMIQUE DES SELLES
Ce chapitre présente les recommandations générales avant prélèvement et les modalités de recueil du prélèvement pour tout examen de selles.
Les recommandations avant prélèvement
- Eviter la consommation d’oléagineux les 2 jours précédant le recueil et les 3 jours du recueil, ainsi que les laxatifs durant la même période.
- Eviter chez les enfants le recueil sur couches, car la déshydratation entraîne un tableau de fausse constipation :préférer un recueil sur une poche
- Pour le dosage de stéatorrhée (recherche de graisses dans les selles) un régime surchargé en graisses peut être demandé au patient
- Faire des recueils avant une investigation par imagerie ou au moins 1 semaine après.
- Pour une recherche de sang dans les selles, le prélèvement ne doit pas être effectué pendant la période des règles ou si le patient souffre de saignement hémorroïdal ou urinaire. Pendant les 48h précédant le recueil, le patient doit éviter de consommer des substances qui peuvent causer des irritations gastro-intestinales et provoquer un saignement occulte (alcool, aspirine ou certains médicaments)
Les modalités de prélèvement et de conservation
- Pour les analyses nécessitant un recueil sur 24h (Clairance alpha1 antitrypsine, Fécalogramme, recherche de laxatifs, Stéatorrhées, Créatorrhées, ionogramme), le recueil de la totalité des selles s’effectue dans un récipient sec (pot à selles d’1 litre) différent pour chacune des journées (si recueil sur 3 jours) et sans contact urinaire. La conservation avant acheminement au laboratoire de biochimie est réalisée à +4°C.
- Pour les analyses nécessitant un simple échantillon (sang dans les selles), un flacon stérile rouge pour les selles est utilisé. La conservation avant acheminement au laboratoire est réalisée à +4°C.